お役立ち情報
カテゴリ
- 再生医療(1)
- メカノバイオロジー(1)
- 三次元培養(3D培養)(3)
- 核酸医薬(2)
- 終末糖化産物(AGEs)(1)
- コラーゲン(6)
- 臨床応用(2)
- 分子クラウディング(1)
- オープンイノベーション(2)
- アンケート(1)
- 解説動画一覧(1)
2018年05月29日
コラーゲンコーティングが実験結果を左右する?

コラーゲンと細胞培養
ご存知のとおり、コラーゲンは細胞接着や細胞増殖の促進のため、培養器材のコーティングによく使用されています。これは、1951年に世界初のヒト株化細胞HeLa細胞の樹立にも成功した、Geyらの1956年の論文が起源になっているようです1)。同論文では、厚さ約3.8mm、直径約3.8cmのディスク状コラーゲンゲルを作製した後、ガラス製のローラーボトル中で一定の水分を除去しています。その後、ヒト由来の24サンプルを含む29の株化細胞や組織がゲル上で培養された結果、カエル皮膚組織を除く28サンプルではガラス上での培養に比べて増殖が促進したようです。尚、同論文の追補には、ローラーボトル内にコラーゲン溶液を直接添加してゲルを作製することやゲルの乾燥に関しても記載されており、現在のコラーゲンコーティングにより近い手法となっています。
培養器材コーティング後のコラーゲンの安定性
その後、コラーゲンの細胞培養への利用が一般的な手法になるにつれ、研究者自身がコーティングを行う手間を省くために、コラーゲンコーティング済みの培養器材が多く販売されています。一方、コラーゲンは空気に触れることで酸化し、分子内架橋を形成することが報告されています。一例として、Nadzirらはコーティング後の培養器材を窒素あるいは大気雰囲気下で保管し、コラーゲンの線維構造を観察したところ、窒素雰囲気下で保管した器材ではコラーゲン線維が観察されたのに対し、大気雰囲気下で保管した器材ではコラーゲン線維の構造が顆粒状に変化していました2)。また、当社にてコラーゲンコーティングを施したプレートや市販のコラーゲンコーティング済みプレートを用いて、初代肝細胞培養後の肝機能を比較したところ、市販のコーティング済みプレートはゼラチンと類似した結果を示したことから、コラーゲンが熱変性をしてしまった可能性が示唆されました。
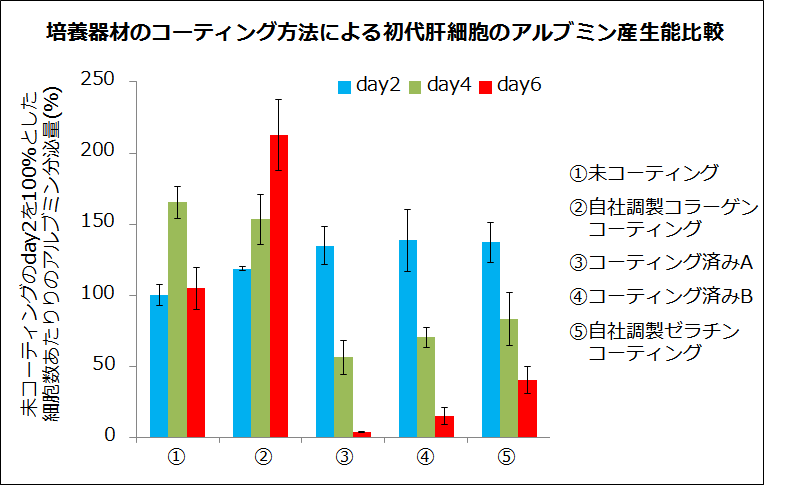
多様なコラーゲンコーティング方法
それでは、自身で培養器材をコーティングする際には、どのような方法が推奨されているのでしょうか。当社にて、コラーゲンメーカーや培養器材メーカーの推奨プロトコル、書籍掲載の推奨プロトコルなど10件ほどを調査したところ、概ね以下のような内容にまとまりました。
| コラーゲン濃度 | コラーゲン溶液添加量 | 添加コラーゲン量 | コーティング時間 | コーティング温度 | コーティング後の溶液 | 洗浄液 | 洗浄回数 |
|---|---|---|---|---|---|---|---|
| 0.001%、 0.050%、 0.100%など |
0.3~0.5mL/24well、 1~2mL/35mmディッシュ 1.5mL/チャンバーなど |
3μg/cm2、 56μg/cm2、 100μg/cm2など |
添加直後に除去、 30分、 一晩など |
室温、 37℃ |
除去、 除去後に風乾 |
PBS、 培地、 滅菌水 |
2回 4~5回 |
注:上記の表は当社が独自にまとめたものであり、お使いの培養器材や細胞によって適切な条件は異なる可能性があります。
当社でも、コラーゲンコーティングの方法を取扱説明書にてご紹介しており、0.3%あるいは0.5%で販売しているコラーゲン酸性溶液を10倍程度に希釈してから使用することで、概ね50μg/cm2前後のコラーゲンを添加量となるように設定しています。尚、初めてご自身でコラーゲンコーティングを施す際には、希釈系列を用いて、使用する細胞に適したコラーゲン濃度の検討を推奨いたします。
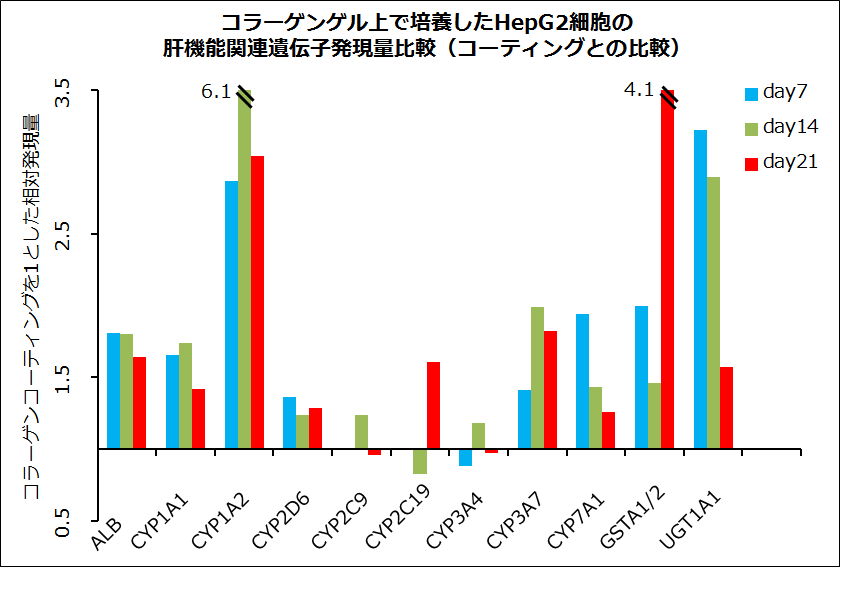
コラーゲンコーティングとコラーゲンゲルの比較
ところで、冒頭でご紹介したGeyらの論文でも、当初はコラーゲンゲル上培養が行われていました。そこで気になるのは、コラーゲンゲル上とコラーゲンコーティングされた培養器材上では、培養された細胞の機能に違いがあるのでしょうか。一例として、当社にてHepG2細胞を用いて両者の比較を行ったデータをご紹介いたします。コラーゲンコーティング培養時の遺伝子発現量を基準にしてゲル上培養時の遺伝子の発現変動を評価したところ、ゲル上培養の方が肝機能関連遺伝子の発現は亢進することが認められました。近年は、細胞が接する培養器材の硬さが細胞機能に影響するというメカノバイオロジー関連の研究報告も増えており、両者間に差が生じる一因となっているのかもしれません。
参考文献
1) The Growth of Cells on a Transparent Gel of Reconstituted Rat-Tail Collagen.
Robert L. Ehrmann and George O. Gey.
J Natl Cancer Inst. 1956 Jun;16(6):1375-403. PMID: 13320119.
2) Effect of preservation conditions of collagen substrate on its fibril formation and rabbit chondrocyte morphology.
Nadzir MM, Kino-oka M, Sugawara K, Taya M.
J Biosci Bioeng. 2012 Sep;114(3):360-3. PMID: 22677065


