お役立ち情報
カテゴリ
- 臨床応用(2)
- 分子クラウディング(1)
- オープンイノベーション(2)
- アンケート(1)
- 解説動画一覧(1)
- 再生医療(1)
- メカノバイオロジー(1)
- 三次元培養(3D培養)(4)
- 核酸医薬(2)
- 終末糖化産物(AGEs)(1)
- コラーゲン(7)
2021年09月28日
やはり違った!アテロコラーゲンやコラーゲン、ゼラチン、コラーゲンペプチド
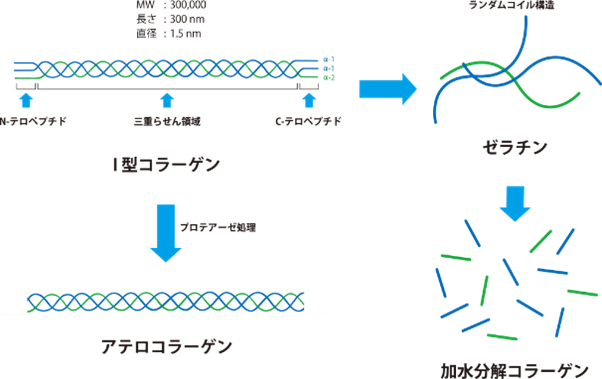
アテロコラーゲンやコラーゲン、ゼラチン、コラーゲンペプチドとは
1930年代頃からコラーゲンの構造解析に関する研究が進み、I型コラーゲンが約1,000個のアミノ酸が結合したポリペプチドから成っており、3本のポリペプチドが三重らせん構造をとった細長い分子であることが示されました。また、生体内に存在するコラーゲンは不溶性の線維状タンパク質であるものの、酸を使って抽出することが可能です。

| 名称 | 一般的な製造方法 | 分子量 | ゲル形成 |
| アテロコラーゲン | 酵素抽出(低温抽出) | 約30万 |
加温するとゲル化(線維化) |
| コラーゲン | 酸抽出(低温抽出) | 約30万 | 加温するとゲル化(線維化) |
| ゼラチン | 酸またはアルカリにて前処理後、加熱処理 | 数万~数十万 | 冷却するとゲル化(線維化ではない) |
| コラーゲンペプチド | 酸・アルカリ・酵素による分解 | 数百~数千 | ゲル化しない |
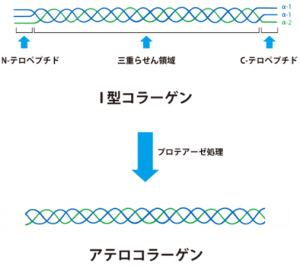
1960年に酵素処理によるコラーゲンの可溶化技術(特許番号:第306922号)が特許出願され、抗原性部位(コラーゲン分子両末端のテロペプチド)が除去された生体適合性の高い非変性のコラーゲン=「アテロコラーゲン」の開発および製品化が行われるようになりました。アテロコラーゲンはコラーゲンと同様の性質を示すため、生理的条件下で分子が配向性を持って重合する「線維化」が起こり、溶液状態で線維化が進むと目に見えるゲルとなります。また、低抗原性が特徴であるため、当社では研究用試薬だけでなく医療機器にも使用しています。
アテロコラーゲン/コラーゲンとゼラチンの違い
両者の最大の違いは3重らせん構造の有無です。アテロコラーゲン/コラーゲンの3重らせん構造の表面に位置する、グリシン-フェニルアラニンなどの疎水性アミノ酸-ハイドロキシプロリン-グルタミン酸-アルギニンからなるGxOGERモチーフとインテグリンの結合を介した細胞との接着が起こります。
一方、皆さんも一度は耳にしたことがあるはずのアルギニン-グリシン-アスパラギン酸からなるRGDモチーフ(配列)は、アテロコラーゲン/コラーゲンとゼラチンのいずれにも存在しますが、アテロコラーゲン/コラーゲンの場合は3重らせんの分子構造に拘束されるため、RGDモチーフとインテグリンの結合を介した細胞との接着は起きないようです。そのため、アテロコラーゲン/コラーゲンとゼラチンと細胞との相互作用は異なるものになります。
尚、アテロコラーゲン/コラーゲンの強度向上によく使用されるEDC架橋は、GxOGERモチーフ中のグルタミン酸を介してコラーゲン側鎖のリシンとアミド結合を形成するため、同モチーフと細胞との結合を阻害すると考えられます。
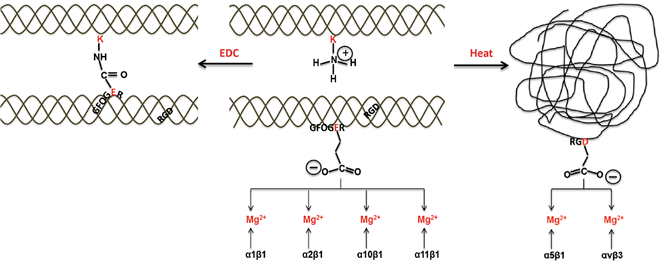
J Mater Sci: Mater Med 27, 148 (2016). Created by cropping figure 1. ©Davidenko N, et al. 2016 (Licensed under CC BY 4.0)
コラーゲンペプチドを用いた研究
上述のようにコラーゲンペプチドの分子量は数百~数千で線維化(ゲル化)もせず、元のコラーゲンとは似ても似つかない性質です。そのため、コラーゲンと同じようにコラーゲンゲル培養の基材として使用されることはありませんが、コラーゲンに特徴的なアミノ酸であるハイドロキシプロリンを含んだジペプチドやトリペプチドの機能についての研究が、多数発表されています。例えば、コラーゲンペプチドを摂取することで、血中のハイドロキシプロリンを含むジペプチドやトリペプチドの量が増加することが示されています。また、コラーゲンペプチドの摂取により、関節炎の軽症化や褥瘡治癒の促進、皮膚状態の改善などの効果が認められたとの報告もあり、コラーゲンペプチドの機能に関する研究は今後も発展していくと見込まれます。
まとめ
生体由来のコラーゲンを元として、抗原性の低いアテロコラーゲン、冷却すると固まるゼラチン、水にも溶けやすいコラーゲンペプチドと、分子量や特徴の大きく異なる物質が得られます。それぞれの物質の細胞との相互作用も必然的に変わるため、お考えの実験に適切なものがわからない場合には、ぜひ一度当社へご相談ください。


