お役立ち情報
カテゴリ
- 再生医療(2)
- メカノバイオロジー(1)
- 三次元培養(3D培養)(6)
- 核酸医薬(3)
- 終末糖化産物(AGEs)(1)
- コラーゲン(11)
- 臨床応用(3)
- 分子クラウディング(1)
- オープンイノベーション(2)
- アンケート(1)
- 解説動画(4)
2019年01月11日
核酸医薬開発の世界での進展(2018年2月14日公開記事の改訂)

核酸医薬開発の再興
核酸医薬は、低分子医薬品のように化学的な合成が可能であり、かつ抗体医薬の特異性の高さを併せ持つと期待され、多くの企業が研究開発を進めていましたが、一時は複数の海外大手製薬企業が核酸医薬開発を停止するなど、しばらくの間停滞ムードが漂っていました。その理由の一つとして、目的の部位へ核酸を届けるためのドラッグデリバリーシステム(DDS)が未成熟であったことが挙げられます。しかし、近年は核酸自体に修飾を加えることで生体内での安定性を高めるなど、DDS担体を用いない核酸医薬の研究も進み、核酸医薬の開発が再度盛り上がりを見せています。
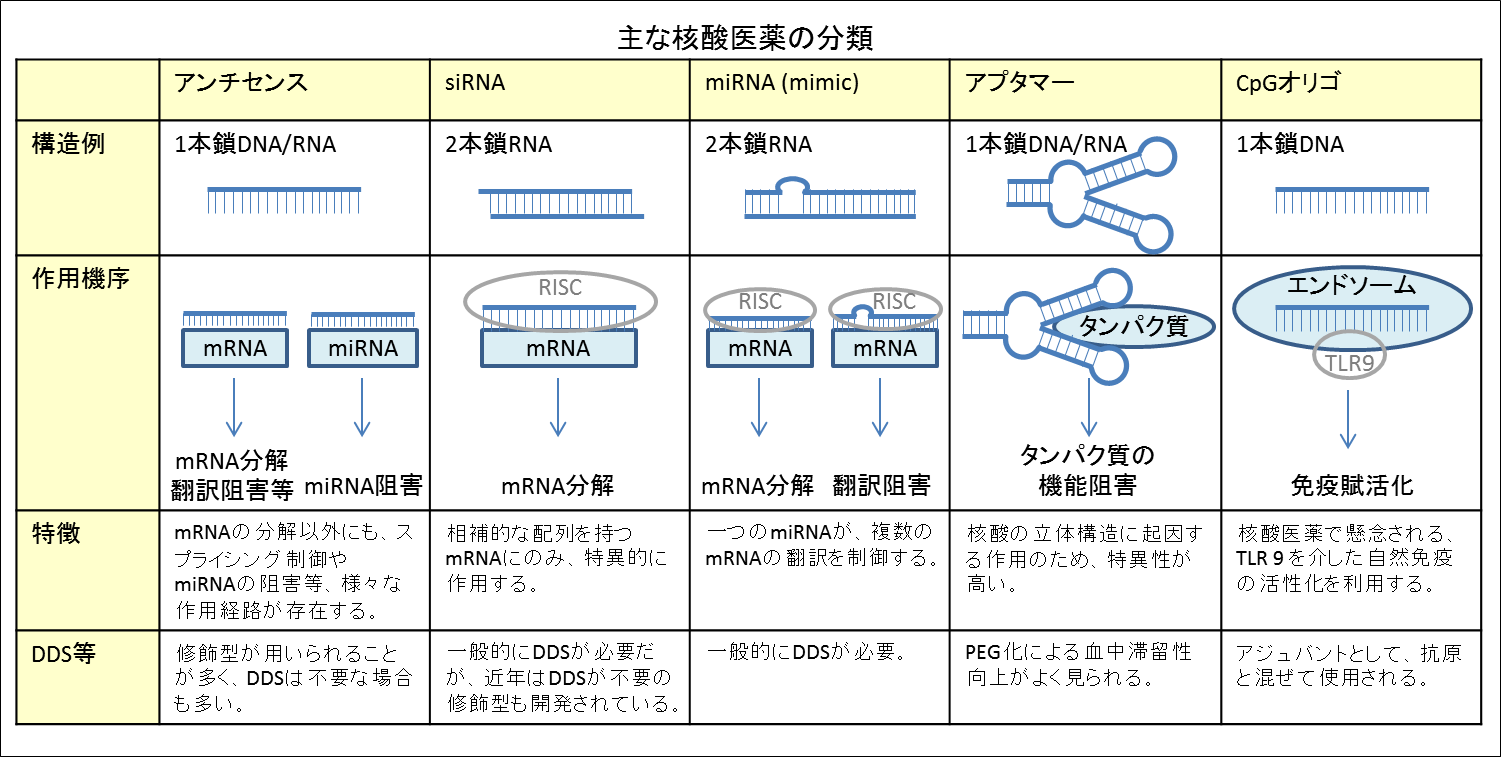
核酸医薬の種類
核酸医薬には複数のタイプが存在しますが、ここでは5つに絞って比較してみたいと思います。まず、一口に核酸医薬と言ってもmRNAなどの核酸を標的にしたものやタンパク質を標的にしたもの、免疫賦活を狙ったものなどがあります。また、核酸医薬は、細胞膜を透過しにくいため、DDS担体と合わせて使用されることが一般的なようです。
承認済み・開発中の核酸医薬品
以下の表のとおり、2019年1月現在では海外企業による9製品が承認を得ており、そのほとんどはアンチセンス医薬品です。体内での滞留性を高めるためにほぼ全ての製品において、何らかの修飾が施された核酸が使用されています。また、当初は患部に直接注入する局所投与製品の承認が続いていましたが、現在では皮下投与や静脈内投与製品も上市されています。さらに、RNAiの発見からちょうど20年となる2018年にsiRNA医薬品のOnpattroが承認されています。尚、Defitelioについては化学合成された核酸ではなく、ブタ腸組織由来の一本鎖オリゴヌクレオチド多分散混合物のため、その他として掲載しています。
| 承認済みの核酸医薬品 | ||||||
| 企業 | 名称 | 一般名 | 核酸の種類 | 対象疾患 | 修飾等 | 投与経路 |
|
Novartis社 [Isis Pharmaceuticals社(現Ionis Pharmaceuticals社)と開発] |
Vitravene 【販売中止】 |
fomivirsen | アンチセンス | CMV 性網膜炎 (AIDS患者) |
リン酸部修飾 S化 |
硝子体内 |
| Valeant Pharmaceuticals社 [EyeTech Pharmaceutical (現Valeant Pharmaceuticals)とPfizer社が開発] |
Macugen | pegaptanib | アプタマー | 滲出型加齢黄斑 変性症 | 5’末端修飾 PEG化 糖部修飾 2′-F 2′-OMe |
硝子体内 |
| Kastle Therapeutics社 [Isis Pharmaceuticals社(現Ionis Pharmaceuticals社)とGenzyme(現Sanofi Genzyme社)が開発] |
Kynamro | mipomersen | アンチセンス | ホモ接合型家族性 高コレステロール血症 |
リン酸部修飾 S化 糖部修飾 2′-MOE |
皮下 |
| Sarepta Therapeutics社 | Exondys 51 | eteplirsen | アンチセンス | デュシェンヌ型 筋ジストロフィー |
モルフォリノ核酸 | 静脈内 |
| Biogen社 [Isis Pharmaceuticals社(現Ionis Pharmaceuticals社)と開発] |
Spinraza | nusinersen | アンチセンス | 脊髄性筋萎縮症 | リン酸部修飾 S化 糖部修飾 2′-MOE |
髄腔内 |
| Dynavax Technologies社 | Heplisav-B | Hepatitis B Vaccine (Recombinant) Adjuvanted |
CpGオリゴ | B型肝炎 | リン酸部修飾 S化 |
筋肉内 |
| Akcea Therapeutics社 [Ionis Pharmaceuticals社と開発] |
Tegsedi | inotersen | アンチセンス | 遺伝性トランスサイレチンアミロイドーシス | リン酸部修飾 S化 糖部修飾 2′-MOE |
皮下 |
| Alnylam Pharmaceuticals社 | Onpattro | patisiran | siRNA | 遺伝性トランスサイレチンアミロイドーシス | 糖部修飾 2′-OMe |
静脈内 |
| その他 | ||||||
| Jazz Pharmaceuticals社 [Gentium社(現Jazz Pharmaceuticals社)が開発] |
Defitelio | Defibrotide | ブタ腸組織由来オリゴヌクレオチド | 肝中心静脈閉塞症 | – | 静脈内 |
注:上記の表は当社が独自にまとめたものであり、最新情報が反映されていない可能性があることご了承ください。
9製品と聞くと、核酸医薬の開発はまだまだ進んでいない印象を受けるかもしれませんが、承認申請中は1件、フェーズ3は15件の開発が進んでいます。少し前のデータになりますが、特許庁の調査によると2015年10月末時点では141件の臨床試験が行われていましたが、現在製品化に近づいている案件が20件弱にも及ぶことから、今後の核酸医薬の発展に期待を持てます。また、開発品の中にはsiRNAも増えてきており、多様な核酸医薬の時代がやってきそうです。
| 主な開発中の核酸医薬品 | ||||
|---|---|---|---|---|
| 企業 | 名称 | 核酸の種類 | 対象疾患 | 開発ステージ |
| Achive Life Sciences社 | custirsen | アンチセンス | 非小細胞肺がん | P3 |
| Gene Signal社 | aganirsen | アンチセンス | 移植患者における角膜血管新生 | P3 |
| aganirsen | アンチセンス | 虚血性網膜中心静脈閉塞症 | P3 | |
| Ionis Pharmaceuticals社 | volanesorsen | アンチセンス | 家族性カイロミクロン血症 | 承認申請中 |
| volanesorsen | アンチセンス | 家族性部分型リポジストロフィー | P3 | |
| alicaforsen | アンチセンス | 回腸嚢炎 | P3 | |
| Sarepta Therapeutics社 | casimersen | アンチセンス | デュシェンヌ型筋ジストロフィー | P3 |
| golodirsen | アンチセンス | デュシェンヌ型筋ジストロフィー | P3 | |
| Ophthotech社 | avacincaptad pegol | アプタマー | ドライ型加齢黄斑変性症 | P2b |
| Idera Pharmaceuticals社 | tilsotolimod | CpGオリゴ | メラノーマ | P3 |
| Alnylam社 | fitusiran | siRNA | 血友病および稀な凝固因子欠乏/異常症 | P3 |
| givosiran | siRNA | 急性肝性ポルフィリン症 | P3 | |
| inclisiran | siRNA | 高コレステロール血症 | P3 | |
| Quark Pharmaceuticals社 | QPI-1002 | siRNA | 臓器移植後臓器機能障害 | P3 |
| QPI-1007 | siRNA | 非動脈炎性虚血性視神経症 | P3 | |
| Sylentis社 | tivanisiran | siRNA | ドライアイ症候群 | P3 |
| Geron社 | imetelstat | 脂質結合オリゴ | 骨髄異形成症候群 | P3 |
注:上記の表は当社が独自にまとめたものであり、最新情報が反映されていない可能性があることご了承ください。
核酸医薬のためのDDS研究
さて、先に挙げた承認品のKynamroは、オリゴ核酸が肝臓や腎臓等に集積しやすい性質を利用して皮下投与、Exondys 51は、オリゴ核酸の取り込みが亢進するデュシェンヌ型筋ジストロフィーの筋細胞の性質を利用して静脈内投与されており、いずれもDDS担体は使用されていません。しかし、上述の様な手法は全ての標的組織や疾患に当てはまるわけではないため、効果的に核酸を届けるためのDDSの研究が進められており、例えばPEG化により血中滞留性の向上したリポソームや、ビタミンA修飾により肝星細胞への標的指向性が向上したリポソームなどが知られています。2018年に承認されたOnpattroでも、リポソームがDDS担体として使用されており、長年の課題であったDDSの実用化が少しずつ進んでいます。
アテロコラーゲンを用いた核酸DDS
当社と外部機関との共同研究において、アテロコラーゲンを核酸DDS担体として応用するための開発が進められ、研究用のアテロコラーゲンDDS担体「AteloGene®」として実用化されています。AteloGene®にはリポソームで懸念されるような高い肝毒性が認められず、また、核酸と複合体を形成すると血管透過性を向上させることが示されています。さらに、尾静脈投与により血流にのせて全身に効率よく核酸をデリバリーする「AteloGene® Systemic Use」に加え、生体内でゲル化する性質を持っているため、核酸が投与部位に留まり徐放効果が得られる「AteloGene® Local Use “Quick Gelation”」選択が可能です。以下の図に示すような様々な疾患モデルへの利用実績があり、今後も多様な研究分野での利用が期待されています。




